79. Біохiмія м’язової тканини. Енергопостачаючі процеси м’язового скорочення.
М’язи (> 40% маси тіла) – молекулярна система, що трансформує хімічну енергію АТФ у механічну енергію скорочення та руху.
Властивості м’язів
• Збудливість
• Скоротливість
• Провідність
Функції м’язів
• підтримка положення тіла
• рух
• кровообіг
• дихання
• моторика ШКТ
• сечовиділення
Типи м’язової тканини: cкелетні м’язи, гладенькі м’язи, серцевий м’яз
Міоцит з сарколеми(електрично-збудлива плазматична мембрана), саркоплазми,міофібрили, саркосоми( скоротлива система).
Саркомер - функціональна одиниця міофібрили
А-диски – анізотропні, темні
•Тонкі (актинові) та товсті
(міозинові) нитки.
•Подвійне променезаломлення.
•При скороченні не змінюють
розмір
І-диски – ізотропні, світлі
•Лише актинові нитки.
•Діляться на дві частини Z-лінією
•Не мають подвійного
променезаломлення.
•При скороченні зникають -
“ковзання актину вздовж міозину”
• Н-зона – центральна зона А-диску
• Містить лише міозин
• Менша оптична щільність
Хімічний склад м’язів: сухий залишок: білки 1)нерозчинні:міофібрилярні, білки строми; 2) розчинні:білки саркоплазми, ліпіди,вуглеводи; Н2О, екстрактивні речовини, мінеральні речовини
Білки м’язів:
1)Саркоплазматичні:міоген:ферменти -глікогенфосфорилаза,ферменти гліколізу,КФК, аденілаткіназа,Міоглобін,Міоальбумін,
2)Міофібрилярні:А. Скоротливі:• міозин, актин, актоміозин
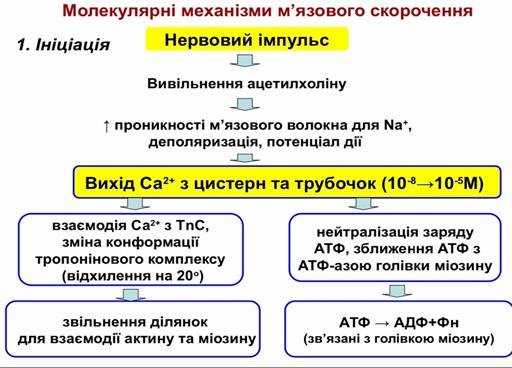
Б. Регуляторні:• Тропоніновий комплекс (тропоніни І, C, Т);• Тропоміозин
α-актинін – компонент Z-лінії саркомерів
Білки строми: колаген, еластин,нейрокератин
Міозин (54%) – основа товстих ниток
• 2 важких ланцюги (2 α-спіралі ), на N-кінці – глобулярна голівка
• 4 легких ланцюги
Функції :
• Структурна: утворюють міозинову нитку (≈ 400 молекул міозину
“хвіст у хвіст”)
• Каталітична: головка міозину має АТФ-азний центр, який
приєднує та розщеплює АТФ
• Контактна: головка міозину має центр для з’єднання з актином
Білки тонких ниток
Актин (25%):G-актин(глобулярний,d=5 нм)F-актин –фібрилярний(полімер Gактину),сполучений з тропоміозином та тропонінами Тропоміозин –паличкоподібні молекули з 2 ланцюгів (α та β).Розміщується між 2 ланцюгамиF-актину (1 мол. контактує з 7 мол. G-актину)
Тропоніновий комплекс:
ТnТ – взаємодіє з тропоміозином
ТnІ – взаємодіє з актином (блокує його зв’язування з голівкою міозину)
ТnС – Са-зв’язуючий білок (по типу кальмодуліну)
Екстрактивні речовини м’язів:1)азотвмісні АТФ, АДФ, АМФ, креатин, креатинін,креатинфосфат,карнітин, –дипептиди (↑ частоту м’язових скорочень, активують роботу іонних насосів, ↑ АТФ-азну активність міозину,антиоксиданти), амінокислоти (глу, глн, ала та ін.),NH3,сечова кислота,сечовина
2)Безазотисті:Вуглеводи: глікоген,глюкоза,метаболіти - ПВК, лактат та ін.,ліпіди:фосфоліпіди,тригліцериди,холестерин,жирні кислоти,мінеральні речовини
Джерела АТФ у м’язах
Субстрати: глікоген, глюкоза, жирні кислоти, кетонові тіла
Енергопостачаючі процеси:
Перші 2-3 сек - клітинні запаси АТФ
3-20 сек - креатинфосфокіназна реакція (КФК):
креатинфосфат + АДФ → АТФ + креатин
Короткотривала робота – анаеробний гліколіз, глікогеноліз:
глюкоза → лактат (2АТФ)
Помірна тривалість роботи – аеробний гліколіз:
глюкоза → СО2+ Н2О (36-38 АТФ)
Тривала робота – окиснення жирних кислот
Жирна кислота → СО2+ Н2О (> 130 АТФ)
В “екстремальних” умовах - міокіназний (аденілаткіназний) шлях:
2 АДФ → АТФ + АМФ
Актин приєднується до голівки міозину → «місток»
• Відщеплення АДФ і Фн від міозину → нахил голівки на 45о відносно актину
• Приєднання нової АТФ до голівки міозину →відщеплення АТФ-міозину від актину →
• Ковзання ниток “актин- міозин” на 1 крок
• приєднання іншої голівки міозину до нового актинового центру

За нестачі АТФ місток між актином і міозином не розщеплюється → контрактура м’язів.
Червоні м’язи (“м’язи-марафонці”): багато міоглобіну,багато мітохондрій,аеробне окиснення глюкози, невисока АТФ-азна активність міозину,скорочуються повільно,тривало, без втоми
Білі м’язи (“м’язи-спринтери”):мало міоглобіну,мало мітохондрій,багато глікогену,анаеробний глікогеноліз, скорочуються швидко,швидко втомлюються
Гладенькі м’язи:повільні (швидкість скорочень в 100-1000 разів менша, ніж у смугастих),Са2+ надходить в саркоплазму з міжклітинного простору і зв’язується з кальмодуліном,комплекс “4 Са2+- кальмодулін” активує кіназу легких ланцюгів міозину (ККЛ), яка фосфорилує міозин
Міозин-АТФ взаємодіє з актином і запускається цикл скорочення
Міокард
· подібний до червоних смугастих м’язів
· аеробний енергетичний обмін
· головний субстрат – жирні кислоти
· після їжі та при фіз. навантаженні - глюкоза та лактат
· Са2+ надходить з екстрацелюлярного простору
· Висока активність КФК-МВ -
- швидке реагування на нестачу АТФ,
- доставка АТФ від мітохондрій до міофібрил