6. Типи інгібірування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування.
Інгібування ферментів - пригнічення
активності ферментів шляхом зв’язування з певними речовинами (інгібіторами). В
залежності від міцності зв’язування з субстратом розрізняють:
- незворотні інгібітори (утворюють міцні ковалентні зв’язки)
- зворотні інгібітори (неміцні, нековалентні зв’язки)
1.Зворотнє конкурентне (ксантиноксидаза)

підвищує KM, але не впливає на Vmax
 2.Зворотнє неконкурентне
2.Зворотнє неконкурентне
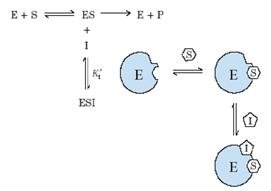
зменшує Vmax, але не впливає на спорідненність ферменту із субстратом.
*Алостеричне інгібування ( належить до неконкурентного) часто здійснюється за механізмом оборотного негативного зв’язку.
*/ Іноді при тривалій дії неконкурентного
інгібітору та утворенні міцних зв’язків із ферментом таке інгібування стає
незворотним/*
3.Незворотні інгібування
E–SH + ICH2–CO–NH2⇝ E–S–CH2–CO–NH2 + HI
Клітинні отрути.
Ціаніди, йони важких металів, інгібітори холінестерази.