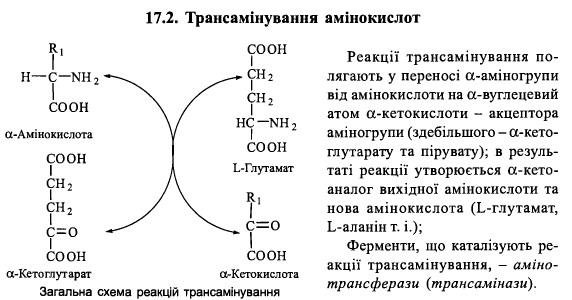
38.Трансамінування амінокислот: реакції та їх біохімічне значення, механізм дії амінотрансфераз.
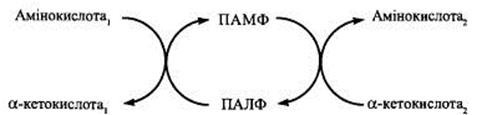
Трансамінування – це процес перенесення аміногрупи з амінокислоти на α-кетокислоту без проміжного утворення аміаку, в результаті чого утворюється нова кетокислота і нова амінокислота.
–кетоглутаратом:a-кетоглутарат і аланін без проміжного утворення аміаку. Ця реакція зворотна. Вона може відбуватися між аланіном і aПроцес переамінування відкрили вчені О. Браунштейн і М. Кріцман (1937), які виявили, що з глутамату і пірувату можуть утворюватися
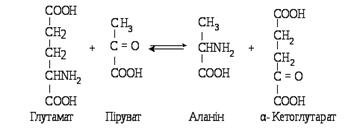
У реакції трансамінування можуть вступати всі амінокислоти, за винятком лізину, треоніну та проліну.
У реакції переамінування донором аміногруп є амінокислота, а акцептором — кетокислота. Здебільшого буває, що одна з кислот є дикарбоновою.
–aкетоглутаратом.Останнім часом установлено, що всі природні амінокислоти зазнають ферментативного переамінування, але з різною швидкістю. З найбільшою інтенсивністю реакція відбувається між глутаміновою кислотою й оксалоацетатом або аспарагіновою та
Ферменти, які каталізують реакції трансамінування називають амінотрансферазами, або трансаміназами. Специфічність трансаміназ забезпечується білковою частиною фермента (апоферментом). Коферментом для них виступає піридоксальфосфат (віт. В6), який у процесі реакції зворотно перетворюється на піридоксамінфосфат.
Процес переамінування за участю піридоксальфосфату (ПАЛФ, О=СН—ФП) з утворенням проміжного продукту фосфопіридоксаміну (ПАМФ, Н2N—СН2—ФП) можна подати за такими рівняннями:
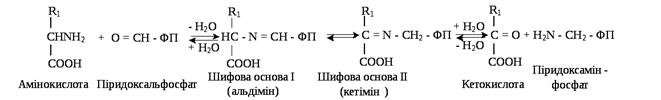
Аміногрупа амінокислот на першій стадії взаємодіє з альдегідною групою фосфопіридоксаль О= СН – ФП з утворенням проміжної шифової основи І типу альдіміну, а потім його таутомерної форми кетіміну (шифова основа ІІ). Далі кетімін гідролізує з утворенням кетоаналога вихідної амінокислоти і ПАМФ.
На другій стадії ПАМФ взаємодіє з новою α-кетокислотою (акцептором аміногрупи) і все повторюється в зворотному порядку, тобто спочатку утворюється кетімін, потім альдімін. Останній гідролізує. У результаті утворюється нова амінокислота і ПАЛФ.
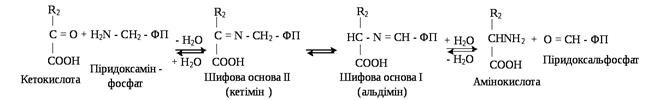
Таким чином, коферменти амінотрансфераз виконують функцію перенесення аміногруп шляхом переходу з альдегідної форми в аміновану і навпаки. При уточненні механізму трансамінування було підтверджено, що у вихідному стані альдегідна група піридоксальфосфату утворює шифову основу (альдімін) з ε-аміногрупою лізинового залишку апофермента з утворенням комплексу ПАЛФ-амінокислота.
У загальному вигляді процес трансамінування можна представити схематично:
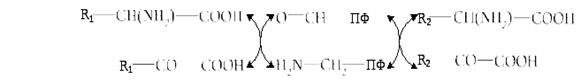
Біологічне значення трансамінування. Трансамінування відіграє надзвичайно важливу роль при синтезі в тканинах одних амінокислот з інших, що дає можливість організму створювати потрібний для нього набір амінокислот. Особливе значення це має для рослинних організмів, де саме так відбувається синтез майже всіх амінокислот. Оскільки цей процес зворотній, то ферменти амінотрансферази функціонують як у процесах катаболізму, так і в біосинтезі амінокислот.
Трансамінування – заключний етап синтезу замінних амінокислоті з відповідних кетокислот, якщо вони потрібні клітині у даний момент. У результаті цього відбувається перерозподіл амінного азоту в організмі. Утворені при трансамінуванні кетокислоти окиснюються в циклі трикарбонових кислот або використовуються для синтезу глюкози і кетонових тіл.
У печінці роль трансамінування полягає в його колекторній функції, тобто збиранні аміногруп від різних амінокислот у вигляді глутамінової кислоти, оскільки глутамат є основним субстратом реакцій дезамінування, тобто постачальником аміногруп для синтезу сечовини – кінцевого продукту азотистого катаболізму.
У м'язах трансамінування призводить до утворення значної кількості аланіну (переамінування амінокислот з піруватом), що виділяється у кров'яне русло і поглинається гепатоцитами, де знову перетворюється на піруват, який використовується в глюконеогенезі (глюкозо-аланіновий цикл).
У клітинах людини виявлено понад 10 амінотрансфераз, які відрізняються за субстратною специфічністю. Вони локалізуються як в цитозолі, так і в мітохондріях клітин еукаріот.
Найпоширенішим ферментом у більшості тканин організму є аланінамінотрансфераза (АлАТ), за зворотною реакцією глутамат-піруватамінотрансфераза (ГПТ) і аспартатамінотрансфераза (АсАТ).
АлАТ каталізує реакцію реакцію трансамінування між аланіном та α-кетоглутаратом. Локалізований цей фермент у цитозолі клітин багатьох органів, але найбільше його виявлено у клітинах печінки і серця. АсАт каталізує реакцію трансамінування між аспартатом і α-кетоглутаратом, знаходиться як в цитоплазмі, так і мітохондріях. Найвища активність цього ферменту в серці та печінці.
Клініко-діагностичне значення визначення трансаміназ. У нормі активність трансаміназ у крові низька. При пошкодженні клітин відповідних органів ферменти виходять у кров, де їх активність різко зростає. Оскільки активність АсАТ і АлАТ найвища у клітинах печінки, серця та скелетних м'язах, то визначення їх активності використовують для діагностики захворювань цих органів. У клітинах серцевого м'язу активність АсАТ значно перевищує АлАт, а а печінці – навпаки. Тому інформативним є визначення співідношення активностей цих ферментів АсАт/АлАт - коефіцієнт де Рітіса. У нормі він становить 1,33 ± 0,42.
Вже через 3 – 5 годин після виникнення інфарктуміокарда рівень АсАТ в крові різко зростає (у 20 – 30 разів), АлАТ – у 1,5-2,0 рази. Максимум активності обох трансаміназ крові припадає на кінець першої доби, а вже через 2 - 3 дні при сприятливому перебігу процесу вона повертається до норми. При інфаркті міокарда значення коефіцієнта де Рітіса різко зростає.
При гепатитах активність АлАт у сироватці крові збільшується у 8-10 разів порівняно з нормою, а АсАТ – в 2-4 рази. Коефіцієнт де Рітіса знижується до 0,6. Однак при цирозі печінки цей коефіцієнт збільшується, що свідчить про некроз клітин, при якому в кров виходять обидві форми АсАТ.
Підвищення рівня трансаміназ сироватки крові спостерігають також при деяких захворюваннях м'язів, зокрема при обширних травмах, гангрені кінцівок та прогресуючій м'язовій дистрофії.
Амінотрансферазні реакції
У різних тканинах організму людини і тварин міститься більше десяти різних амінотрансфераз, що розрізняються за своєю субстратною специфічністю.
Найбільш поширеними є такі амінотрансферази:
(1) аланінамінотрансфераза (глутамат-піруваттрансаміназа - ГПТ):
L-аланін + а-кетоглутарат = Піруват + L-глутамат
(2) аспартатамінотрансфераза (глутамат-оксалоацетаттрансаміназа - ГОТ):
L-аспартат + а-кетоглутарат = Оксалоацетат + L-глутамат
(3) тирозинамінотрансфераза:
L-тирозин + а-кетоглутарат = р-гідроксифенілпіруват + L-глутамат
(4) лейцинамінотрансфераза:
L-лейцин + а-кетоглутарат = а-кетоізокапроат + L-глутамат
Реакції трансамінування, що каталізуються амінотрансферазами, активно перебігають в багатьох органах, найактивніше - в печінці, скелетних м’язах, міокарді, головному мозку, нирках. Визначення активності аланіналйнотрансферази (аламінової трансамінази - АлАТ) та аспартатамінотрансферази (аспарагінової трансамінази - АсАТ) широко застосовується в медичній практиці з мстою діагностики пошкоджень внутрішніх органів. Внаслідок виходу цих ферментних білків через ушкоджені клітинні мембрани в кров при інфаркті міокарда спостерігається значне
підвищення активності в сироватці крові АсАТ, при вірусних та токсичних пошкодженнях печінки - АлАТ.
Механізм дії