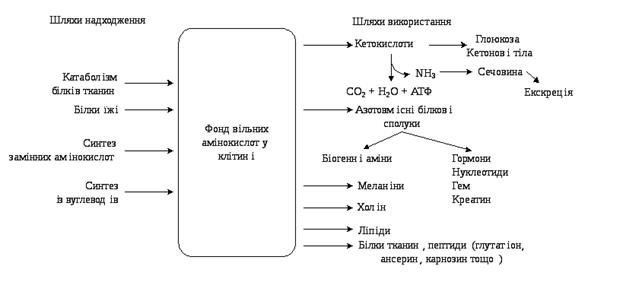
37.Пул амінокислот. Шляхи використання амінокислот в організмі. Глюкогенні та кетогенні амінокислоти. Дезамінування вільних L-амінокислот в тканинах.
Значення амінокислот для організму, в першу чергу, визначається тим, що вони використовуються для синтезу білків, метаболізм яких займає особливе місце у процесах обміну речовин між організмом та зовнішнім середовищем. Пояснюється це тим, що білки входять у всі основні структурні компоненти клітин, тканин і органів організму, виконують ферментативні функції, беруть участь у перенесенні речовин через мембрани тощо.
Амінокислоти безпосередньо беруть участь у біосинтезі не тільки білків, але й великої кількості інших біологічно активних сполук, що регулююють процеси обміну речовин в організмі, таких як нейромедіаторів та гормонів. Амінокислоти виступають донорами азоту при синтезі всіх азотовмісних небілкових сполук, в тому числі нуклеотидів, гему, креатину, холіну та інших речовин.
Катаболізм амінокислот може служити джерелом енергії для синтезу АТФ. Енергетична функція амінокислот має важливе значення при голодуванні, деяких патологічних станах (цукровий діабет тощо) і переавжно при білковому харчуванні. Обмін амінокислот здійснює взаємозв'язок різноманітних хімічних перетворень у живому організмі.
Дезамінування амінокислот – це процес відщеплення аміногрупи від амінокислоти з утворенням молекули аміаку. Розрізняють декілька типів дезамінування: відновне, окиснювальне, гідролітичне і внутрішньомолекулярне. Тип дезамінування амінокислот залежить від умов і виду організмів. В організмі людини відновного дезамінування зазнають амінокислоти в травному тракті під впливом мікрофлори кишечника. У тканинах людини відбувається тільки окиснювальне дезамінування. крім аміаку в цих реакціях можуть утворюватися безазотисті речовини: насичена або ненасичена жирна кислота, кето- або оксикислота, що залежить від виду дезамінування.
Відновне дезамінування амінокислот відбувається за схемою:
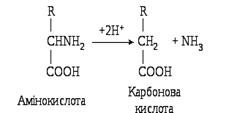
Внаслідок відновного дезамінування утворюються аміак і карбонова кислота.
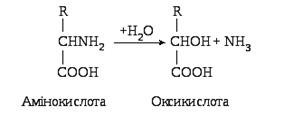
Продуктами, які утворюються при гідролітичному дезамінуванні–оксикислота:a, є аміак і
При внутрішньомолекулярному дезамінуванні відбувається відщеплення аміаку за рахунок внутрішньомолекулярного перегрупування з утворенням ненасиченої кислоти за схемою:
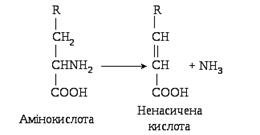
Гідролітичне та внутрішньомолекулярне дезамінування характерні для деяких мікроорганізмів і нижчих тварин.
У випадку окиснювального дезамінування амінокислот утворюються аміак і кетокислота:
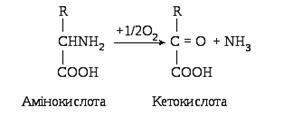
Процес окиснювального дезамінування відбувається у два етапи, першим з яких є процес дегідрування з утворенням імінокислоти, на другому етапі утворюється кетокислота і вивільняється аміак. В організмі людини і тварин найбільш активно дезамінується глутамінова кислота:
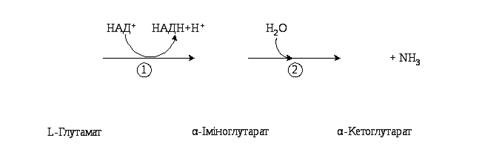
Перший етап – утворення α-іміноглутарату - каталізується ферментом НАД-залежною глутаматдегідрогеназою, що локалізована у мітохондріях. Другий етап – утворення α–кетоглутарату відбувається без участі ферменту. Утворений α-кетоглутарат окиснюється у циклі трикарбонових кислот, а аміак поглинається ферментативною системою синтезу сечовини. Зворотній процес – відновне амінування α-кетоглутарату до глутамату може відбуватися в цитозолі при участі НАДФ-залежної глутаматдегідрогенази і бути одним із механізмів зв'язування аміаку.
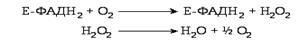
Існує кілька ферментів в організмі людини, що каталізують такі реакції, їх називають оксидазами. Оксидази L-амінокислот можуть містити як ФМН, так і ФАД, а оксидази D-амінокислот тільки ФАД у ролі простетичної групи. У печінці та нирках міститься неспецифічна оксидаза L-амінокислот, яка за фізіологічних умов малоактивна, оскільки рН її дії = 10. Її простетичною групою є ФМН. Значно активніша в організмі людини оксидаза D-амінокислот, ФАД-залежний фермент, що виділений з нирок, печінки та мозку. Відновлені флавіннуклеотиди (ФМН Н2 та ФАД Н2) оксидаз L- і D-амінокислот можуть окиснюватися молекулярним киснем, утворюючи при цьому водню перксид, який під впливом каталази розщеплюється на воду та кисень.
Глутаматдегідрогеназа є єдиним високоефективним ферментом, що діє на амінокислоти L-ряду в організмі вищих тварин і людини. Це олімерний фермент (М.м. 312 000 Да), який складається із 6 субодиниць (М.м. кожної субодиниці приблизно 52 000 Да) і проявляє свою активність тільки у мультиферментній формі. Розрізняють три різних типи глутаматдегідрогенази: один з них використовує в якості коферменту як НАД, так і НАДФ (організми тварин); два інших використовують або НАД, або НАДФ (мікроорганізми, клітини рослин і грибів) і відповідно каталізують дезамінування або біосинтез глутамату.
При дисоціації цієї молекули на субодиниці, що відбувається у присутності НАДН АТФ, ГТФ та деяких стероїдних гормонів, фермент втрачає свою основну глутаматдегідрогеназну активність і набуває властивості дезамінувати низку інших амінокислот. Висока концентрація АДФ активує глутаматдегідрогеназу, завдяки якій амінокислоти перетворюються на кетокислоти, які згодом поступають у цитратний цикл як енергетичні субстрати. Глутаматдегідрогеназа може індукуватися стероїдними гормонами (кортизол), що свідчить про алостеричну природу цього ферменту.
Аміак, утворений при дезамінуванні амінокислот, є токсичною речовиною для організму, тому він знешкоджується і використовується для синтезу кінцевих продуктів азотистого обміну – сечовини, сечової кислоти або амонійних солей і виділяється з організму із сечею.
-кетокислоти, в організмі хребетних та інших тварин, де вони утворюються, окиснюються до СОaБезазотисті сполуки, зокрема 2 і Н2О. Частина кетокислот використовується для синтезу амінокислот шляхом відновного амінування або переамінування.
У печінці роль трансамінування полягає в його колекторній функції, тобто збиранні аміногруп від різних амінокислот у вигляді глутамінової кислоти, оскільки глутамат є основним субстратом реакцій дезамінування, тобто постачальником аміногруп для синтезу сечовини – кінцевого продукту азотистого катаболізму.
Глюкогенні амінокислоти
L-Амінокислоти, що метаболізуються в циклі трикарбонових кислот, можуть включати свої вуглецеві скелети в молекули глюкози. Ці амінокислоти, використання яких у синтезі глюкози реалізується після їх входження в ЦТК через ацетил-КоА,а-кетоглутарат, сукциніл-КоА та фумарат, отримали назву глюкогенних амінокислот.
Кетогенні амінокислоти
Дві L-амінокислоти включаються в катаболізм тільки через ацетоацстил-КоА, який у клітинах печінки може перетворюватися на кетонові тіла ацетоацетат та β-гідроксибутират. Це - кетогенні амінокислоти. Деякі амінокислоти віддають свої вуглецеві фрагменти на утворення як глюкози, так і кетонових тіл.
Кетогенез із амінокислот має особливо негативне значення при деяких порушеннях ферментних процесів, зокрема при некомпенсованому цукровому діабеті, у зв’язку з чим таким хворим рекомендується обмежувати надходження кетогенних амінокислот у складі продуктів харчування.